Numero atomico
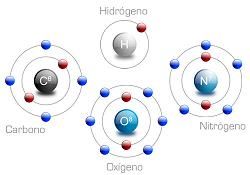
L'atomo è la più piccola porzione di qualsiasi elemento chimico, che non può essere trasformato in un atomo e ha un'esistenza indipendente. Gli atomi sono costituiti da elettroni che orbitano intorno a un nucleo con neutroni e protoni.
Gli atomi di elementi diversi hanno quantità diverse di protoni. Il numero atomico (identificato dalla lettera Z, dal termine tedesco number) indica il numero di protoni presenti nel nucleo di un atomo. Questo numero, quindi, è responsabile della definizione della configurazione elettronica dell'atomo e permette l'ordinamento dei vari elementi chimici in una sequenza periodica, che inizia con l'idrogeno (Z = 1) e prosegue con elio, litio, berillio, boro, carbonio e azoto.
Dobbiamo anche aggiungere che il numero di protoni nel nucleo di un determinato atomo è uguale al numero di elettroni che lo circondano in quella che si chiama la crosta.
Dall'elenco degli elementi chimici stabilito in base al loro numero atomico possiamo determinare che fa capo a questi dieci elementi: con 1 idrogeno, con numero 2 elio, 3 è per litio, 4 è berillio, 5 è occupato da boro, 6 è carbonio , 7 è azoto, 8 è ossigeno, 9 è fluoro e 10 è neon.
A questo possiamo anche aggiungere che in totale questo elenco è composto da un totale di 115 elementi chimici, l'ultimo dei quali è ununoctio. Presumibilmente si tratta di un gas nobile incolore che ha il seguente simbolo temporaneo: Uuo.
È importante notare che un atomo invariato è elettricamente neutro: ciò significa che il suo numero atomico sarà sempre uguale al suo numero di elettroni.
Mentre la tavola periodica degli elementi è attribuita solo a Dimitri Mendeleev (responsabile dell'ordinamento degli elementi in base alle variazioni delle proprietà chimiche), colui che specificò l'organizzazione basata sulle proprietà fisiche degli atomi fu Julius Lothar Meyer.
Tuttavia, non si può ignorare l'importante ruolo svolto dal fisico e chimico inglese Henry Moseley, che stabilì la propria legge dei numeri atomici, nota come legge Moseley. Fu nel 1913 che fu pubblicato che stabilì che esisteva una chiara relazione sistematica tra la lunghezza d'onda dei raggi X emessi dagli atomi e il loro numero atomico.
In questo modo, con questa scoperta, questo chimico britannico arrivò ad opporsi o contrastare le proposte avanzate quattro decenni prima dal già citato Mendeleev.
Abbiamo già detto che il numero di protoni (espresso dal numero atomico) è uguale al numero di elettroni. Il numero di massa (A), nel frattempo, indica il numero di particelle che un atomo ha nel suo nucleo. Esprime quindi la massa di protoni e neutroni. In breve, è possibile stabilire la seguente relazione tra il numero atomico e il numero di massa: A = Z + N, dove N è uguale al numero di neutroni.
 Definizione
Definizione
