Ponte salino
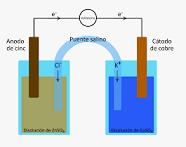
Il concetto di ponte salino è usato nel campo della chimica per riferirsi a un elemento usato nei laboratori. Questo dispositivo permette di collegare le semicelle di riduzione e rimozione di una batteria o cella galvanica.
Quello che fa il ponte di sale è di ottenere l'isolamento dei contenuti che si trovano nelle diverse parti della cella preservando il contatto elettrico che esiste tra le due.
Quando si lascia una mezza cella della pila per passare all'altra, gli elettroni di file causano una differenza di potenza tra loro. Con il ponte di uscita, questa differenza non impedisce il flusso di altri elettroni. Tuttavia, il ponte salino permette il flusso in modo da mantenere l'equilibrio della carica tra le metà di ossidazione e di riduzione, anche in modo che i contenuti di ciascuna rimangano separati.
Così, grazie al ponte salino, la differenza di carica è equilibrata, gli elettroni continuano a scorrere e le reazioni redox (riduzione e ossidazione) possono continuare. Più comunemente, le due celle sono tenute separate in modo che le variabili possano essere riprese in sicurezza nel contesto di un esperimento. Non permettendo agli elettroliti di entrare in contatto diretto, gli scienziati non dovrebbero nemmeno essere a conoscenza delle potenziali interazioni tra diverse specie inorganiche.
Grazie a questa tecnica, è possibile scegliere liberamente lo ione nella soluzione. Questo accade, tra l'altro, quando un catione viene volontariamente lasciato cadere in una miscela per ottenere i risultati desiderati nell'esperimento. Usando un ponte salino, un catione può essere isolato in un posto mentre l'altro può essere usato per facilitare il processo, per esempio usando un sale più stabile o solubile.
E' importante notare che è possibile usare ponti salini con una carta da filtro o un tubo di vetro.
Una carta da filtro a ponte salino è impregnata di cloruro di sodio o di potassio, che sono elettroliti chimicamente inerti. La conducibilità del contenitore di sale è legata al maggiore o minore assorbimento della soluzione elettrolitica e alla temperatura.
Un contenitore di sale in tubo di vetro, nella parte anteriore, contiene un file elettrolitico che è relativamente inerte, come il cloruro di sodio o lo ioduro di potassio. Un agente gelificante è spesso usato per evitare che i fluidi si gonfino.
Il concetto di contenuto salino è legato a quello di deossiemoglobina, il nome dato all'emoglobina quando il sangue che scorre nelle vene perde ossigeno. L'emoglobina è il pigmento rosa presente nel sangue degli animali vertebrati e cattura l'ossigeno dai polimorfi per trasportarlo ai tessuti, così come l'anidride carbonica da questi ultimi per trasportarla ai primi per l'escrezione.
La deossiemoglobina è anche conosciuta come emoglobina rossa ed è caratterizzata da un colore rosa scuro. Ciascuna delle sue subunità, che compongono il file della struttura terziaria, e la comunicazione tra le quattro strutture quaternarie è stabilita per mezzo di otto ponti salini. Questo fenomeno è conosciuto come interazioni elettrostatiche, e quindi sono coinvolte le catene laterali di vari amminoacidi, oltre a due gruppi finali delle catene alfa, l'amino e il carbossile.
In una catena alfa Dato, il suo gruppo amminico finale forma un ponte salino con il carbossile finale seguente. D'altra parte, il gruppo guanidinio, cioè la catena laterale, della seconda catena alfa forma un altro ponte salino, in questo caso con quello di un altro. Osservando e studiando i diversi tipi di amminoacidi, è possibile codificare i colori.
 Definizione
Definizione
