Legame ionico
Gli atomi sono composti da elettroni (che sono caricati negativamente e orbitano intorno a un nucleo), neutroni e protoni. Attraverso una forza conosciuta come legame chimico, gli atomi rimangono legati insieme.
Questo legame o legame può avvenire in diversi modi. Nel caso del legame ionico, si verifica quando gli elettroni sono trasferiti da un atomo all'altro. Nel legame covalente, invece, gli elettroni non vengono trasferiti, ma condivisi.
I legami chimici sono legati alla cosiddetta regola dell'ottetto, che afferma che gli atomi tendono a completarsi con otto elettroni per ottenere stabilità. Così, per raggiungere questo numero, gli atomi condividono, accettano o cedono elettroni.
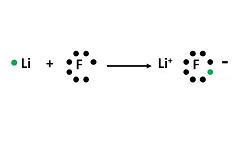
Tornando al caso dei legami ionici, gli atomi prendono o cedono elettroni secondo la regola dell'ottetto. A causa dell'attrazione elettrostatica tra ioni di segno diverso (uno elettronegativo e uno elettropositivo), uno degli atomi riceve elettroni dall'altro. Così si sviluppa un composto chimico semplice, che non implica la fusione.
Il legame ionico di solito lega un metallo a un non-metallo. Il metallo cede elettroni, formando cationi stabili. Il non-metallo, a sua volta, riceve questi elettroni dal metallo, dando origine a un anione che ha anche una configurazione stabile. L'idrogeno, per esempio, raggiunge l'ottetto con due elettroni, mentre l'alluminio lo raggiunge con sei.
Ogni legame ionico ha una serie di caratteristiche ben definite, come le seguenti:
* presentano legami di notevole forza, e questo dipende in gran parte dalla natura degli ioni;
* a temperatura ambiente, sono solidi e la loro struttura, dal punto di vista della cristallografia (la scienza che studia e risolve le strutture cristalline, cioè le forme solide dell'ordine e il modo in cui molecole, ioni e atomi sono impaccati), è cristallina. È importante notare che i cosiddetti "sali fusi" o "liquidi ionici" non soddisfano questo punto, ma sono liquidi;
* i loro punti di fusione e di ebollizione sono alti, anche se possono diminuire se il legame ha un alto carattere covalente;
* risultano dall'interazione tra due gruppi: metalli I e II, e non-metalli VI e VII;
* poiché l'acqua ha un dipolo elettrico, che è in grado di solvare gli ioni per compensare l'energia del reticolo cristallino, i legami ionici sono solubili in acqua. Questo non è vero per tutti i composti, e le ragioni includono la bassa energia di solvatazione o il carattere covalente;
* già in una soluzione acquosa diventano perfetti conduttori di elettricità, poiché gli ioni vengono rilasciati;
* in contrasto con il punto precedente, un legame ionico allo stato solido non è elettricamente conduttivo, a causa della bassa mobilità dei suoi ioni nel reticolo.
Per testare queste ultime due caratteristiche dei legami ionici, è possibile eseguire un piccolo esperimento con elementi facilmente reperibili, anche se è importante prendere alcune precauzioni per evitare incidenti. Se creiamo un semplice circuito elettrico per alimentare una lampadina, con un filo tagliato in due parti e unito da un blocco di sale, il risultato sarà zero; allo stesso modo, se sostituiamo il sale con l'acqua, anche la lampadina non si accenderà.
Tuttavia, se sciogliamo molto sale in acqua e immergiamo le due estremità del filo, alla fine il circuito funzionerà come previsto, poiché gli ioni disciolti nel sale potranno muoversi e cercare il polo opposto della batteria.
 Definizione
Definizione
