Reazione chimica
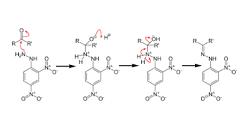
Una reazione è l'effetto di una certa azione. La chimica, invece, è il nome dato alla scienza orientata all'analisi della composizione, delle proprietà e dei cambiamenti della materia.
Con questi concetti chiari, possiamo passare alla definizione di reazione chimica. Questa nozione si riferisce alle alterazioni che, a causa di vari fattori, certe sostanze possono subire. Una reazione chimica, quindi, fa sì che una sostanza acquisisca proprietà diverse, con cambiamenti nei suoi legami e nella sua struttura.
Una reazione chimica può essere intesa, in breve, come il processo che porta a trasformare una sostanza (chiamata reagente) in un'altra con proprietà diverse. Questa seconda sostanza è conosciuta come il prodotto.
La reazione chimica comporta la scomparsa di certe proprietà e l'emergere di altre. I legami che esistevano tra gli atomi dei reagenti vengono rotti, portando al riarrangiamento atomico e alla formazione di nuovi legami. Ecco perché la sostanza risultante dalla reazione chimica ha caratteristiche diverse dalla sostanza originale.
Le reazioni si sviluppano in modo diverso a seconda che si tratti di chimica organica o inorganica. È possibile distinguere, d'altra parte, tra una reazione chimica endotermica (che comporta l'assorbimento di energia all'interno della reazione) e una reazione chimica esotermica (l'energia, in questo caso, viene rilasciata).
È importante notare che, in tutte le reazioni chimiche, la massa si conserva (la massa dei prodotti è uguale alla massa dei reagenti) poiché gli atomi si riorganizzano, ma non vengono rimossi o creati nuovi atomi.
Uno dei concetti legati alla reazione chimica è la velocità di reazione, che è intesa come la quantità di sostanza che passa attraverso una trasformazione in una certa reazione per unità di tempo e volume. Per fare due esempi opposti, il butano può essere trasformato in fuoco attraverso la combustione in meno di un secondo, mentre l'ossidazione del ferro può richiedere diversi anni. Ci sono alcuni fattori che influenzano direttamente la velocità di reazione, come i seguenti:
* concentrazione: come esposto dalla teoria della collisione (la spiegazione qualitativa di come avvengono le reazioni chimiche e perché la velocità differisce in ogni caso) e descritto dalla legge della velocità (l'espressione con cui è possibile calcolare la velocità di reazione, e metterla in relazione alle concentrazioni dei reagenti), maggiore è la concentrazione, più veloce è la velocità di reazione. All'aumentare della concentrazione delle sostanze coinvolte nella reazione chimica, aumenta anche la frequenza di collisione (se le particelle che reagiscono non si scontrano, non può esserci reazione);
* pressione: poiché aumentare la pressione equivale ad aumentare la concentrazione di un gas, questo può far sì che una reazione gassosa avvenga più rapidamente. Nelle reazioni in fase condensata, l'impatto della pressione è significativo solo quando il suo valore è molto alto;
* natura della reazione: in parole povere, alcune reazioni chimiche richiedono meno tempo di altre semplicemente per loro natura;
* ordine: il grado in cui la pressione o la concentrazione influenzano il tasso dipende dall'ordine della reazione chimica;
* temperatura: generalmente, quando avviene una reazione, una temperatura più alta si riflette in un maggiore apporto di energia nel sistema, aumentando così anche il tasso. La spiegazione di questo fenomeno risiede nel fatto che, insieme alla temperatura, aumenta il numero di particelle in collisione con l'energia necessaria per la riuscita della reazione chimica.
* temperatura: generalmente, quando avviene una reazione, una temperatura più alta si riflette in un maggiore apporto di energia nel sistema, aumentando così il tasso.
 Definizione
Definizione
