Oxoanion
Il concetto di oxoanione è usato in chimica. Per capire a cosa allude, è importante tenere a mente diverse nozioni.
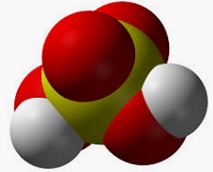
Un oxoanione è uno ione negativo che deriva da un oxoacido. Quando un ossiacido perde idrogeno, diventa un oxoanione.
L'ione è un atomo o un gruppo di atomi che, guadagnando o perdendo uno o più elettroni (particelle elementari caricate negativamente), acquista una carica elettrica. In questo caso, lo ione guadagna elettroni, quindi la sua carica è negativa.
Come ogni ione caricato negativamente, d'altra parte, l'oxoanione è un anione. Il suo atomo centrale è di solito un non-metallo, legato ad almeno un atomo di ossigeno.
Prima di andare avanti, è importante menzionare che un ossiacido è un acido che contiene ossigeno. È formato da ossigeno, idrogeno e almeno un altro elemento. Quando si scioglie in acqua, l'acido si dissocia e ciascuno dei suoi atomi di idrogeno si separa, cedendo il suo elettrone al resto della molecola. Così, l'oxoacido diventa un oxoanione.
Si può citare una lunga lista degli oxoanioni più frequenti. Per prima cosa, guardiamo quelli con gruppi terminali di ossido: carbonato, borato, nitrito, nitrato, nitrato, iponitrito, silicato, alluminato, fosfito, fosfato, ipofosfito, solfato, persolfato, solfito, iposolfito, clorato, perclorato, clorite, ipoclorito, permanganato, cromato e manganato.
D'altra parte, ci sono oxoanioni che, oltre ai gruppi terminali di ossido, hanno altri gruppi di collegamento tra una coppia di atomi non metallici, e sono i seguenti: pirofosfato, bicromato, poliossometalati (fosfowolframati, fosfomolibdati, ecc.).
Un semplice oxoanione ha una formula che segue la cosiddetta regola degli ottetti. Questo significa che l'atomo non idrogeno tende a legarsi condividendo, perdendo o guadagnando elettroni fino a quando non è circondato da otto elettroni di valenza. Al di là di questo, bisogna notare che ci sono eccezioni a questa regola.
La regola dell'ottetto fu enunciata da Gilbert Newton Lewis, un importante fisico-chimico americano, nel 1916. In poche parole, definisce che nel sistema periodico, cioè nella tavola degli elementi chimici, gli ioni di questi elementi tendono a terminare i loro livelli energetici con un numero di elettroni uguale a otto, per cui la loro configurazione è altamente stabile. La stabilità intrinseca di un elemento che segue la regola dell'ottetto significa che non è molto probabile che reagisca con un altro elemento.
Un altro nome con cui è conosciuto l'oxoanione semplice è monomero. Quelli che seguono la regola dell'ottetto sono di solito quelli del secondo periodo della tabella, poiché hanno orbitali 2s e 2p, che possono contenere fino a otto elettroni. Le eccezioni includono alcune molecole che hanno un numero dispari di elettroni e sono quindi altamente reattive. L'instabilità di queste molecole è dovuta al fatto che tendono a formare legami con l'elettrone "extra", cioè quello dispari.
Due semplici oxoanioni del secondo periodo sono lo ione nitrato e lo ione carbonato. La loro struttura è del tipo a piramide trigonale, perché ognuno dei loro atomi di ossigeno ha una coppia di elettroni in comune con quello centrale, che sono posti il più lontano possibile a causa della repulsione causata dalle loro rispettive cariche negative. Quindi, poiché ci sono tre coppie di elettroni condivisi tra gli atomi, si formano angoli di 120 gradi tra di loro.
Ci sono, d'altra parte, gli oxoanioni condensati. Quando un oxoanione ha una carica elevata, è possibile che subisca una reazione di condensazione. Uno degli esempi più comuni è la formazione dello ione dicromato, una reazione in cui un monomero agisce come base e un condensato come acido coniugato.
 Definizione
Definizione
