Allotropia
La nozione di allotropia è usata nel campo della chimica per indicare la proprietà di alcuni elementi chimici che hanno diverse caratteristiche fisiche o diverse strutture molecolari. Si chiama molecola che è composta da un solo elemento e ha diverse strutture allotropiche. Nella sua etimologia, troviamo che è composto dagli altri componenti, dai composti circostanti e da un suffisso che indica "qualità".
È importante notare che le proprietà allotropiche si presentano in elementi di composizione equivalente ma con aspetti diversi, se si trovano allo stato solido. In altre parole, lo stato di aggregazione della materia deve essere lo stesso affinché le proprietà siano verificate.
La diversità delle proprietà è legata al modo in cui le proprietà sono organizzate nello spazio. Questa particolarità significa che lo stesso elemento chimico può presentare più conformazioni. Il fosforo, per esempio, può apparire come un fosforo bianco o come un fosforo rosso. In un senso simile, il carbonio, in base a vari fattori, appare come diamante o grafite.
L'allotropia è presente anche nell'ossigeno. L'O2 (ossigeno ambientale) che si trova nell'atmosfera può essere respirato dagli esseri viventi e permette la combustione. L'O3 (ozono), invece, è tossico e assorbe le radiazioni ultraviolette. Come potete vedere, l'ossigeno è un elemento chimico dotato di allotropia.
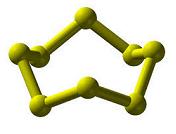
L'allotropia si può notare anche nell'ozono. Possiamo trovare strutture come lo zolfo plastico, lo zolfo alfa, lo zolfo monoclino e lo zolfo fuso, tra gli altri allotropi dello stesso elemento.
Si deve notare che, nel caso dello zolfo, esistono diverse forme cristalline, con unità strutturali che sono intrise in modi diversi. Ecco perché ci sono esperti che parlano di polimorfismo e non di allotropia. Per evitare una potenziale confusione tra i due concetti, si raccomanda di intendere l'allotropia come forme diverse dello stesso elemento con unità molecolari diverse. Nel carbonio e in altri elementi, ciò che cambia sono i legami chimici che compongono gli atomi.
Continuando con il polimorfismo, lo zolfo è in grado di produrre cristalli monoclinici di colore giallo intenso (in questo caso la sua forma ricorda, in ogni angolo, la lama di un bisturi, uno strumento da taglio manuale usato per modellare o lucidare il legno) o cristalli romboidali-ambra (la forma di questi cristalli può essere definita come quella di un parallelepipedo, un corpo geometrico composto da due parallelogrammi, di cui solo quelli opposti sono paralleli e uguali).
Mentre gli esseri umani conoscono il peccato di zolfo fin dall'antichità, il che ci riporta alla preistoria, è stato solo alla fine del XX secolo che hanno capito l'allotropia che possiede questo elemento. In natura, il più comune di questi è il ciclo octa-zolfo, che se non raggiunge una temperatura di 95°C forma cristalli di spessore relativo, mentre al di sopra di questo i cristalli risultanti sono aciculari (cioè hanno un aspetto o una forma aghiforme).
La prima sintesi di un allotropo dello zolfo, tuttavia, fu effettuata nel 1891, con un anno di dimensioni diverse da otto. Si trattava di un ciclo di esazufre, il secondo di tutti i veri allotropi di questo elemento ad essere trovato.
I limiti delle misure degli anelli degli allotropi di zolfo che è stato possibile sintetizzare alla fine sono 6 e 20, anche se la scienza stima che ce ne siano alcuni con anelli superiori a questi ultimi valori. Di tutti questi, quello che ha mostrato la maggiore stabilità, oltre al ciclo otta-zolfo, è il ciclo dodecazufre (la sua dimensione è 12).
 Definizione
Definizione
