Unione covalente
Prima di addentrarci nella definizione di unione covalente, è necessario che procediamo a conoscere l'origine etimologica delle due parole che le danno forma:
- Unione è un termine che deriva dal latino, precisamente da "unus", che può essere tradotto come "uno".
-Covalente, d'altra parte, deriva anche dal latino suddetto. Nel suo caso, è la somma di tre componenti: il prefisso "con-", che equivale a "insieme"; il verbo "valere", che può essere tradotto come "valere"; e il suffisso "-nte", che è usato per indicare l'agente.
Un'unione è un legame tra due o più elementi. Covalente, invece, è un concetto usato in chimica per riferirsi al legame che gli atomi formano quando condividono coppie di elettroni.
Il concetto di legame covalente, quindi, si riferisce a un tipo di legame che gli atomi stabiliscono. È importante notare che gli atomi sono composti da elettroni, neutroni e protoni. Gli elettroni, che hanno una carica negativa, orbitano intorno al nucleo atomico.
Molti esempi sono usati per spiegare cos'è un legame covalente e dove si può trovare. Così, per esempio, tra i più comuni c'è quello che si concentra sul gas cloro. Questo è composto da molecole di Cl2 in cui i due atomi di cloro sono uniti dal suddetto legame covalente.
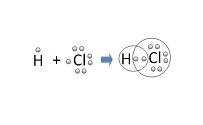
Un legame chimico è la forza che fa rimanere uniti gli atomi. Ci sono diversi tipi di legami: il legame covalente è quando gli atomi condividono elettroni a coppie.
Quando si legano, gli atomi possono condividere, accettare o cedere elettroni. Gli elettroni nell'ultimo guscio atomico, chiamati elettroni di valenza, sono quelli che possono essere condivisi.
Secondo la regola dell'ottetto, gli atomi tendono a completarsi con otto elettroni di valenza per ottenere stabilità. Per accedere a questo numero, gli atomi cedono, accettano o, nel caso del legame covalente, condividono atomi.
Gli atomi non metallici sono i protagonisti del legame covalente. Gli elettroni di valenza, in questo caso, sono condivisi da due atomi: cioè, fanno parte di più di un atomo. Il legame può essere triplo, doppio o singolo, a seconda dei casi.
Il legame covalente è quindi diverso dal legame ionico, dove gli elettroni sono trasferiti da un atomo all'altro.
Per quanto riguarda i cosiddetti legami covalenti, bisogna sottolineare che esiste una base fondamentale che è necessario conoscere. Ci riferiamo alla cosiddetta Teoria di Lewis o Struttura, che stabilisce i seguenti principi o massime del suddetto legame:
-Si sceglie l'atomo centrale, che, come regola generale, è di solito il meno elettronegativo.
-Si contano gli elettroni di Valencia.
-Si formano legami tra l'atomo centrale e quelli periferici.
-I rimanenti elettroni si dispongono come coppie solitarie per completare i suddetti ottetti.
 Definizione
Definizione
