Solvatazione
La solvatazione non è un termine accettato nel dizionario compilato dalla Reale Accademia Spagnola (RAE). È un concetto solitamente utilizzato nel campo della chimica in riferimento al processo che coinvolge l'attrazione e l'associazione degli ioni di un soluto e le molecole di un solvente.
Per capire la nozione, quindi, dobbiamo prima sapere a cosa si riferiscono gli altri termini. Una miscela omogenea composta da un solvente (noto anche come soluto) e uno o più soluti è chiamata soluzione. In questa miscela, i soluti si dissolvono nel solvente: quindi, c'è un livello più alto di solvente che di soluto nella soluzione.
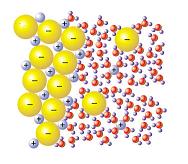
Quando gli ioni soluti si dissolvono, avviene la solvatazione. Questi ioni si separano l'uno dall'altro e cominciano ad essere circondati dalle molecole che compongono il solvente. La solvatazione dello ione è legata alla sua dimensione, poiché la quantità di molecole di solvente che lo circondano dipende dalla sua dimensione.
Solvatazione si può dire che avviene dalle interazioni di un soluto con un solvente, portando alla stabilizzazione del soluto in soluzione. Il processo richiede che gli ioni del reticolo cristallino vengano liberati: ciò richiede la rottura dell'attrazione tra gli ioni dovuta all'energia del reticolo. Gli ioni soluti, quando si associano con le molecole di solvente, rilasciano un tipo di energia chiamata energia libera di solvatazione.
È importante non confondere i concetti di solubilità, dissoluzione e solvatazione, anche se a prima vista possono avere alcune somiglianze. Mentre la dissoluzione si riferisce all'aggiunta di soluto a un solvente, o all'aumento della percentuale di solvente in una soluzione precedentemente esistente, il termine solubilità si riferisce alla quantità massima di soluto che può essere aggiunto al solvente prima che la sua formazione sia precipitata, cioè prima che si formi un'eccedenza di soluto non disciolto.
Tornando alla solvatazione, è possibile parlare di uno stato solvatato per descrivere la situazione in cui uno ione in una data soluzione è complessato dalle molecole del solvente. Il termine complessato, d'altra parte, significa formato da un minimo di due componenti che sono associati attraverso un legame chimico chiamato legame di coordinazione, che di solito è meno forte di un normale legame covalente.
Un altro concetto che entra in gioco in questo contesto è quello di solvente polare. Questo è quello che ha una struttura molecolare con dipoli e di solito ha un'alta costante dielettrica. Le sue molecole polari sono in grado di effettuare la solvatazione dello ione perché possono cambiare l'orientamento della porzione parzialmente carica verso lo ione come risultato dell'attrazione elettrostatica.
Un tale processo di solvatazione dello ione ha come risultato che il sistema diventa stabile. Tra i solventi polari più conosciuti, l'acqua è al primo posto, perché è stata studiata di più ed è la più facile da trovare in natura; a questo gruppo appartengono anche il dimetilsolfossido, l'acetonitrile, il metanolo, l'ammoniaca, l'acetone, l'etanolo e il carbonato di propilene. Possono essere utilizzati per sciogliere i sali, tra altri composti inorganici.
C'è più di un tipo di interazione molecolare che avviene durante la solvatazione: ione-dipolo, ponte idrogeno, forze di Londra o attrazione dipolo-dipolo. Tranne le forze di Londra, le altre si trovano solo nei solventi polari. Le forze ione-ione, invece, si verificano nei solventi ionici (un caso possibile è la fase fusa).
 Definizione
Definizione
