Proteine intere
Le proteine sono gli elementi costitutivi della materia vivente. Questi elementi sono costituiti da amminoacidi (costituiti, a loro volta, da un gruppo carbossilico e da un altro amminoacido).
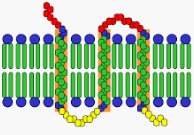
Le proteine coinvolte in una membrana plasmatica, in questo quadro, fanno parte di un doppio strato lipidico. Pertanto, se queste proteine vengono separate, la membrana plasmatica (conosciuta anche come membrana citoplasmatica o membrana cellulare) subisce la disintegrazione della sua struttura.
Queste proteine integrali svolgono varie funzioni, contribuendo all'adesione cellulare e al trasporto di materiale, per esempio. In base alle loro caratteristiche, è possibile differenziare diversi tipi di proteine integrali.
Ci sono due gruppi principali: proteine integrali transmembrana e proteine intermedie non transmembrana. In questa seconda serie, a sua volta, si fanno diverse distinzioni.
Le proteine transmembrana integrali co-coprono il doppio strato lipidico interno. Al contrario, questo non accade con le proteine integrali non transmembrana. D'altra parte, è possibile tracciare una separazione tra le proteine interne e le proteine periferiche, che sono raggiunte al file di membrana dal lato esterno e dal basso.
Si nota che la membrana plasmatica è composta da lipidi e proteine. L'ottanta per cento di queste proteine sono integrali o intrinseche, mentre il resto è periferico o estrinseco.
Incorporate nel bilayer lipidico, le proteine intermedie possono passare attraverso la membrana cellulare una o più volte e possono condividere su uno o entrambi i lati, o essere legate ad essa da legami covalenti. Per isolare le proteine rilevanti, è necessario ablare il doppio strato lipidico.
Passando alle proteine transmembrana, dobbiamo sottolineare che ne esiste più di un tipo, e questa classificazione è costruita prendendo come riferimento la loro struttura. Prima di tutto, abbiamo il file single-step, un tipo di proteina intera che passa attraverso il doppio strato solo una volta. Su entrambe le lamine di membrana ci sono i termini N-terminali e C-terminali. Questo gruppo comprende, tra gli altri, gli enzimi dell'apparato Golgi-PTK e i recettori. Uno degli esempi più documentati è la glicoforina che si trova negli eritrociti.
Al tempo stesso, all'interno di questo tipo di proteina integrale, il suo dominio può essere classificato in due gruppi diversi:
* transmembrana: ha una struttura secondaria la cui lunghezza è tra 25 e 30 aminoacidi e la sua forma è di alfa eliche. La maggior parte dei suoi residui laterali sono idrofobici (alcuni esempi sono leucina, isoleucina e alanina) perché devono interagire con il contenuto del doppio filamento attraverso forze di Van der Waals e idrofobiche. Dobbiamo sottolineare che all'interno dell'elica non c'è disponibilità per il suo utilizzo come canale. Alle su estremità, invece, possono essere presenti residui carichi che comunicati con i fosfolipidi;
* non transmembrana: Questa sottoclasse di proteine integrale è solamente globulare e idrofila. Sono mantenuti da forze elettrostatiche e legami idrogeno e la loro lunghezza può variare. A volte le catene di oligosaccaridi e i lipidi solubili SS si trovano nel dominio extracitosolico, cosa che non avviene nel dominio citosolico.
L'altro grande gruppo di proteine transmembrana integrali multi-pass è chiamato l'altro grande gruppo di proteine. In questo caso, il doppio strato lipidico è attraversato un minimo di due volte, solo per mezzo di più elisir alfa, anche se i beta-fogli possono ancora essere presenti. I canali ionici, le proteine G trimeriche e le porine in-batteria sono tre dei numerosi esempi presenti.
All'occorrenza, questi si dividono in:
* multi-passo in alfa elica: hanno un numero di eliche uguale al numero di giri che attraversano la membrana;
* multi-passo in beta-fiamma: sono meno frequenti dei precedenti e il loro numero di passi può variare da otto a ventidue.
* multi-passo in beta-fiamma: sono meno frequenti dei precedenti e il loro numero di passi può variare da otto a ventidue.
 Definizione
Definizione
