Elettrochimica
L'elettrochimica è il ramo della chimica fisica che si concentra sulle leggi relative alla generazione di elettricità mediante combinazioni chimiche. La chimica fisica, invece, è la scienza che analizza i legami tra le proprietà chimiche e fisiche di una materia.
Uno degli scopi dell'elettrochimica è capire le reazioni chimiche che avvengono all'interfaccia di un elettrodo e un elettrolita. L'elettrodo è l'estremità di un conduttore elettrico che è in contatto con un mezzo e che permette di ricevere o trasmettere una corrente elettrica. L'elettrolita, invece, è la sostanza sottoposta a elettrolisi (cioè un processo di decomposizione in ioni causato dalla corrente).
Quando c'è un trasferimento di elettroni tra le molecole coinvolte in una reazione chimica, si tratta di una reazione di riduzione-ossidazione (reazione redox). Queste reazioni sono fondamentali per la produzione di elettricità.
Il trasferimento che avviene nella reazione redox è tra elementi ossidanti e riducenti. In questo quadro, l'energia viene rilasciata e trasformata in elettricità.
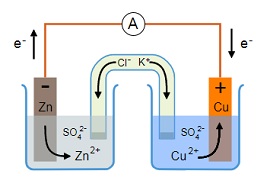
Una cella elettrochimica è un dispositivo che utilizza una reazione chimica per produrre energia elettrica o viceversa (quando l'aggiunta di energia elettrica produce una reazione chimica). Una cella voltaica o galvanica, in questo contesto, è un tipo di cella elettrochimica che acquisisce energia elettrica grazie alle reazioni redox spontanee che avvengono al suo interno.
Le batterie sono semplici celle voltaiche. Le batterie elettriche, a loro volta, sono composte da diverse celle voltaiche collegate in parallelo o in serie.
 Definizione
Definizione
